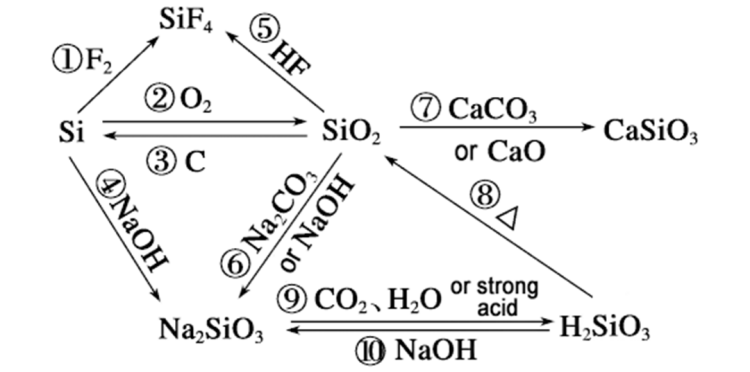
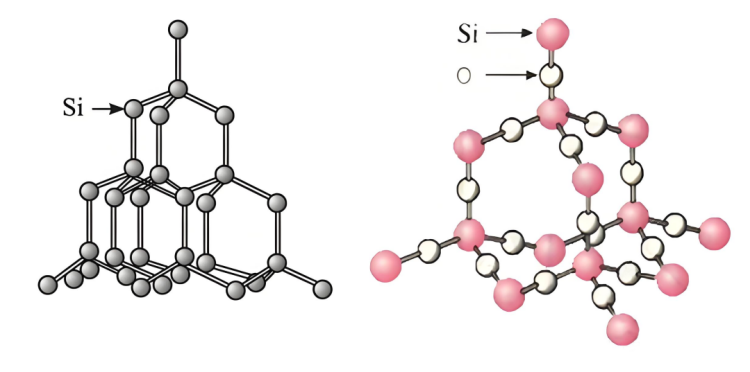
Proč je reakční rychlostkřemíka hydroxid sodný může překonat oxid křemičitý, lze analyzovat z následujících hledisek:
Rozdíl v energii chemické vazby
▪ Reakce křemíku a hydroxidu sodného: Když křemík reaguje s hydroxidem sodným, energie vazby Si-Si mezi atomy křemíku je pouze 176 kJ/mol. Během reakce se vazba Si-Si přeruší, což je relativně snadnější přerušení. Z kinetického hlediska je reakce probíhající snadněji.
▪ Reakce oxidu křemičitého a hydroxidu sodného: Energie vazby Si-O mezi atomy křemíku a atomy kyslíku v oxidu křemičitém je 460 kJ/mol, což je relativně vysoká hodnota. K přerušení vazby Si-O během reakce je zapotřebí vyšší energie, takže reakce probíhá relativně obtížně a rychlost reakce je pomalá.
Různé reakční mechanismy
▪ Křemík reaguje s hydroxidem sodným: Křemík reaguje s hydroxidem sodným nejprve reakcí s vodou za vzniku vodíku a kyseliny křemičité, poté kyselina křemičitá reaguje s hydroxidem sodným za vzniku křemičitanu sodného a vody. Během této reakce se uvolňuje teplo mezi křemíkem a vodou, které může podpořit molekulární pohyb, a tím vytvořit lepší kinetické prostředí pro reakci a urychlit rychlost reakce.
▪ Oxid křemičitý reaguje s hydroxidem sodným: Oxid křemičitý reaguje s hydroxidem sodným nejprve reakcí s vodou za vzniku kyseliny křemičité, poté kyselina křemičitá reaguje s hydroxidem sodným za vzniku křemičitanu sodného. Reakce mezi oxidem křemičitým a vodou je extrémně pomalá a reakční proces v podstatě neuvolňuje teplo. Z kinetického hlediska nevede k rychlé reakci.
Různé materiálové struktury
▪ Křemíková struktura:Křemíkmá určitou krystalovou strukturu a mezi atomy existují určité mezery a relativně slabé interakce, což usnadňuje roztoku hydroxidu sodného kontakt a reakci s atomy křemíku.
▪ Strukturakřemíkoxid:křemíkOxid má stabilní prostorovou síťovou strukturu.KřemíkAtomy křemíku a atomy kyslíku jsou pevně vázány kovalentními vazbami a tvoří tvrdou a stabilní krystalovou strukturu. Pro roztok hydroxidu sodného je obtížné proniknout do jeho nitra a plně se dotknout atomů křemíku, což má za následek obtíže s rychlou reakcí. S hydroxidem sodným mohou reagovat pouze atomy křemíku na povrchu částic oxidu křemičitého, což omezuje rychlost reakce.
Vliv podmínek
▪ Reakce křemíku s hydroxidem sodným: Za zahřívacích podmínek se rychlost reakce křemíku s roztokem hydroxidu sodného výrazně zrychlí a reakce může obecně probíhat hladce při vysokých teplotách.
▪ Reakce oxidu křemičitého s hydroxidem sodným: Reakce oxidu křemičitého s roztokem hydroxidu sodného je při pokojové teplotě velmi pomalá. Obvykle se reakční rychlost zlepší za drsných podmínek, jako je vysoká teplota a koncentrovaný roztok hydroxidu sodného.
Čas zveřejnění: 10. prosince 2024