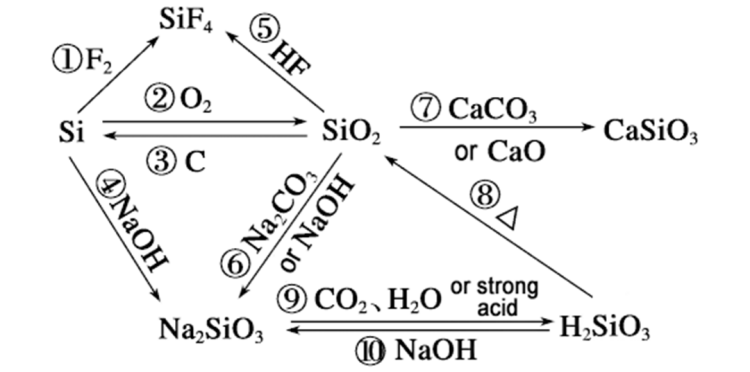
Pam mae cyfradd adwaithsilicona gall sodiwm hydrocsid ragori ar silicon deuocsid o'r agweddau canlynol:
Gwahaniaeth mewn egni bond cemegol
▪ Adwaith silicon a sodiwm hydrocsid: Pan fydd silicon yn adweithio â sodiwm hydrocsid, dim ond 176kJ/mol yw egni'r bond Si-Si rhwng atomau silicon. Mae'r bond Si-Si yn torri yn ystod yr adwaith, sy'n gymharol haws i'w dorri. O safbwynt cinetig, mae'r adwaith yn haws i fynd rhagddo.
▪ Adwaith silicon deuocsid a sodiwm hydrocsid: Mae ynni'r bond Si-O rhwng atomau silicon ac atomau ocsigen mewn silicon deuocsid yn 460kJ/mol, sy'n gymharol uchel. Mae'n cymryd mwy o ynni i dorri'r bond Si-O yn ystod yr adwaith, felly mae'r adwaith yn gymharol anodd i ddigwydd ac mae'r gyfradd adwaith yn araf.
Mecanweithiau adwaith gwahanol
▪ Mae silicon yn adweithio â sodiwm hydrocsid: Mae silicon yn adweithio â sodiwm hydrocsid yn gyntaf trwy adweithio â dŵr i gynhyrchu hydrogen ac asid silicig, yna mae asid silicig yn adweithio â sodiwm hydrocsid i gynhyrchu sodiwm silicig a dŵr. Yn ystod yr adwaith hwn, mae'r adwaith rhwng silicon a dŵr yn rhyddhau gwres, a all hyrwyddo symudiad moleciwlaidd, a thrwy hynny greu amgylchedd cinetig gwell ar gyfer yr adwaith a chyflymu'r gyfradd adwaith.
▪ Mae silicon deuocsid yn adweithio â sodiwm hydrocsid: Mae silicon deuocsid yn adweithio â sodiwm hydrocsid yn gyntaf trwy adweithio â dŵr i gynhyrchu asid silicig, yna mae asid silicig yn adweithio â sodiwm hydrocsid i gynhyrchu sodiwm silicig. Mae'r adwaith rhwng silicon deuocsid a dŵr yn hynod araf, ac nid yw'r broses adwaith yn rhyddhau gwres yn y bôn. O safbwynt cinetig, nid yw'n ffafriol i adwaith cyflym.
Strwythurau deunydd gwahanol
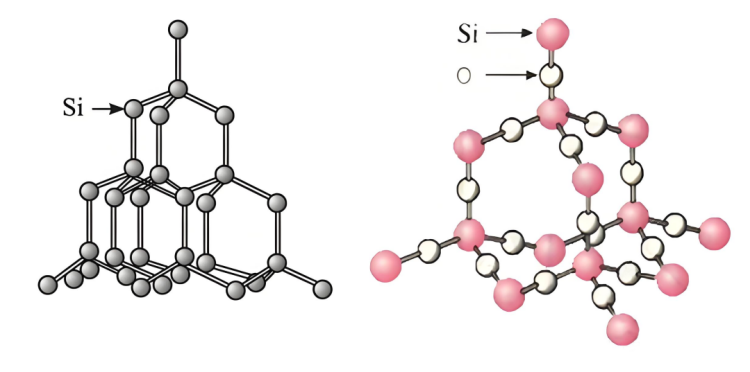
▪ Strwythur silicon:Siliconmae ganddo strwythur crisial penodol, ac mae bylchau penodol a rhyngweithiadau cymharol wan rhwng atomau, gan ei gwneud hi'n haws i doddiant sodiwm hydrocsid gysylltu ac adweithio ag atomau silicon.
▪ Strwythursilicondeuocsid:siliconMae gan ddeuocsid strwythur rhwydwaith gofodol sefydlog.SiliconMae atomau ac atomau ocsigen wedi'u clymu'n dynn gan fondiau cofalent i ffurfio strwythur crisial caled a sefydlog. Mae'n anodd i doddiant sodiwm hydrocsid dreiddio i'w du mewn a chysylltu'n llawn ag atomau silicon, gan arwain at anhawster mewn adwaith cyflym. Dim ond atomau silicon ar wyneb gronynnau silicon deuocsid all adweithio â sodiwm hydrocsid, gan gyfyngu ar y gyfradd adwaith.
Effaith amodau
▪ Adwaith silicon â sodiwm hydrocsid: O dan amodau gwresogi, bydd cyfradd adwaith silicon â hydoddiant sodiwm hydrocsid yn cael ei chyflymu'n sylweddol, a gall yr adwaith fynd rhagddo'n esmwyth ar dymheredd uchel yn gyffredinol.
▪ Adwaith silicon deuocsid â sodiwm hydrocsid: Mae adwaith silicon deuocsid â hydoddiant sodiwm hydrocsid yn araf iawn ar dymheredd ystafell. Fel arfer, bydd y gyfradd adwaith yn gwella o dan amodau llym fel tymheredd uchel a hydoddiant sodiwm hydrocsid crynodedig.
Amser postio: 10 Rhagfyr 2024