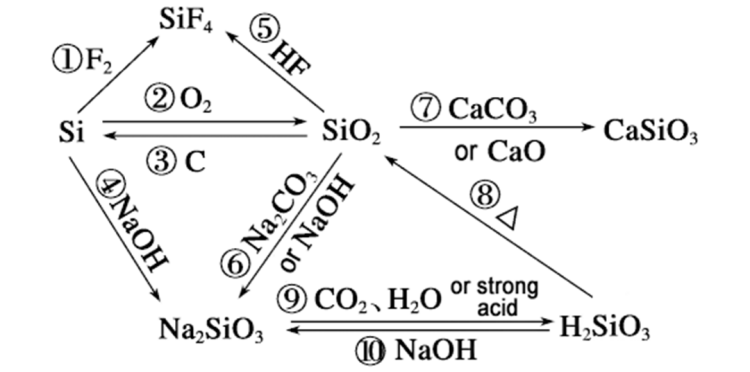
반응속도가 왜규소수산화나트륨은 이산화규소보다 우수할 수 있으며, 다음과 같은 측면에서 분석할 수 있습니다.
화학 결합 에너지의 차이
▪ 실리콘과 수산화나트륨의 반응: 실리콘이 수산화나트륨과 반응할 때, 실리콘 원자 사이의 Si-Si 결합 에너지는 176kJ/mol에 불과합니다. 반응 중 Si-Si 결합이 끊어지기 때문에 상대적으로 쉽게 끊어집니다. 반응 속도론적 관점에서 볼 때, 반응은 더 쉽게 진행됩니다.
▪ 이산화규소와 수산화나트륨의 반응: 이산화규소에서 규소 원자와 산소 원자 사이의 Si-O 결합 에너지는 460kJ/mol로 비교적 높습니다. 반응 중 Si-O 결합을 끊는 데 더 많은 에너지가 필요하기 때문에 반응이 일어나기 어렵고 반응 속도가 느립니다.
다양한 반응 메커니즘
▪ 실리콘은 수산화나트륨과 반응합니다. 실리콘은 먼저 수산화나트륨과 반응하여 물과 반응하여 수소와 규산을 생성하고, 규산은 수산화나트륨과 반응하여 규산나트륨과 물을 생성합니다. 이 반응에서 실리콘과 물의 반응은 열을 방출하여 분자 운동을 촉진하고, 반응에 더 나은 운동 환경을 조성하여 반응 속도를 가속화합니다.
▪ 이산화규소는 수산화나트륨과 반응합니다. 이산화규소는 먼저 수산화나트륨과 반응하여 물과 반응하여 규산을 생성하고, 규산은 수산화나트륨과 반응하여 규산나트륨을 생성합니다. 이산화규소와 물의 반응은 매우 느리며, 반응 과정에서 기본적으로 열이 발생하지 않습니다. 반응 속도론적 관점에서 볼 때, 빠른 반응에는 적합하지 않습니다.
다양한 재료 구조
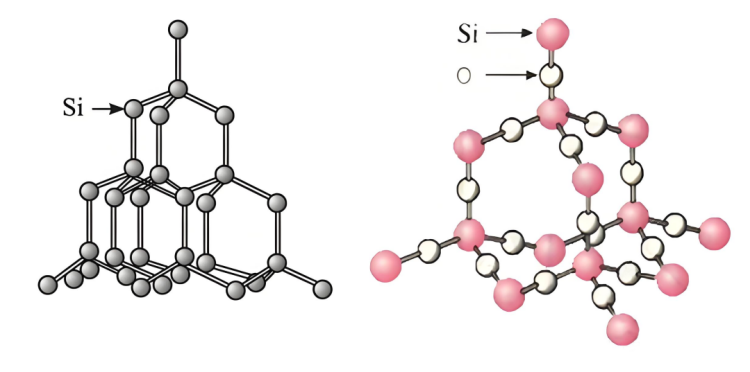
▪ 실리콘 구조:규소특정한 결정 구조를 가지고 있으며, 원자 사이에 특정한 틈과 비교적 약한 상호 작용이 있어 수산화나트륨 용액이 실리콘 원자와 접촉하고 반응하기가 더 쉽습니다.
▪ 구조규소이산화물:규소이산화탄소는 안정적인 공간적 네트워크 구조를 가지고 있습니다.규소원자와 산소 원자는 공유 결합으로 단단히 결합되어 단단하고 안정적인 결정 구조를 형성합니다. 수산화나트륨 용액이 내부로 침투하여 규소 원자와 완전히 접촉하기 어려워 빠른 반응이 어렵습니다. 이산화규소 입자 표면에 있는 규소 원자만이 수산화나트륨과 반응할 수 있어 반응 속도가 제한됩니다.
조건의 영향
▪ 실리콘과 수산화나트륨의 반응: 가열 조건 하에서 실리콘과 수산화나트륨 용액의 반응 속도는 상당히 가속화되며 반응은 일반적으로 고온에서 원활하게 진행됩니다.
▪ 이산화규소와 수산화나트륨의 반응: 이산화규소와 수산화나트륨 용액의 반응은 실온에서 매우 느립니다. 일반적으로 고온 및 진한 수산화나트륨 용액과 같은 가혹한 조건에서는 반응 속도가 향상됩니다.
게시 시간: 2024년 12월 10일