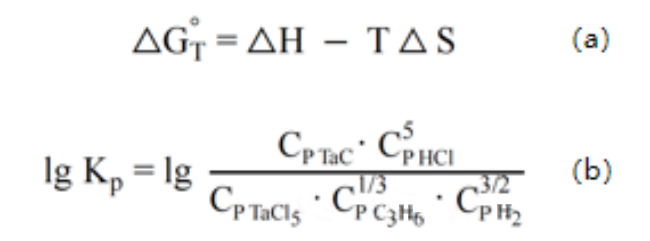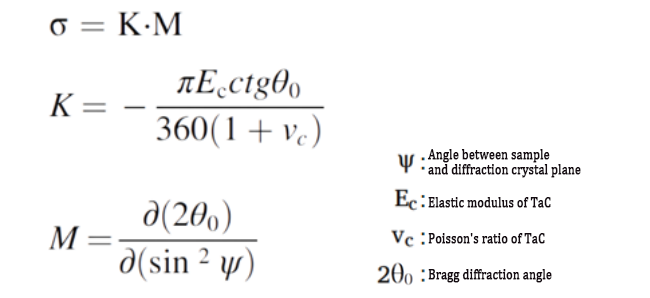1. استكشاف معلمات العملية
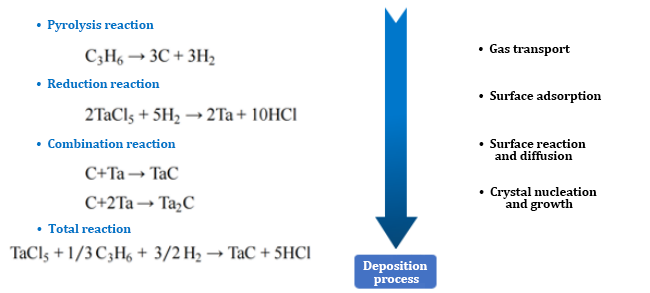
1. نظام TaCl5-C3H6-H2-Ar
2. درجة حرارة الترسيب:
وفقًا للصيغة الديناميكية الحرارية، يُحسب أنه عند درجة حرارة أعلى من ١٢٧٣ كلفن، تكون طاقة جيبس الحرة للتفاعل منخفضة جدًا، ويكون التفاعل مكتملًا نسبيًا. يكون ثابت التفاعل KP كبيرًا جدًا عند ١٢٧٣ كلفن، ويزداد بسرعة مع درجة الحرارة، ويتباطأ معدل النمو تدريجيًا عند ١٧٧٣ كلفن.
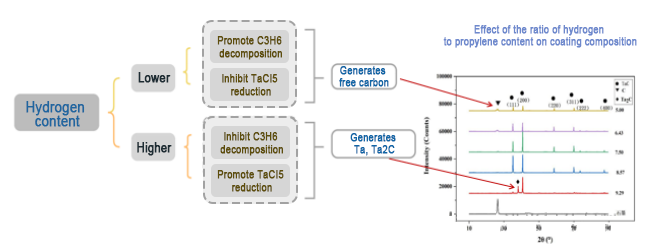
التأثير على مورفولوجيا سطح الطلاء: عندما لا تكون درجة الحرارة مناسبة (مرتفعة جدًا أو منخفضة جدًا)، فإن السطح يقدم مورفولوجيا كربونية حرة أو مسام فضفاضة.
(1) عند درجات الحرارة العالية، تكون سرعة حركة ذرات أو مجموعات المواد المتفاعلة النشطة سريعة جدًا، مما يؤدي إلى توزيع غير متساوٍ أثناء تراكم المواد، ولا يمكن للمناطق الغنية والفقيرة الانتقال بسلاسة، مما يؤدي إلى ظهور المسام.
(2) هناك فرق بين معدل تفاعل التحلل الحراري للألكانات ومعدل تفاعل اختزال خماسي كلوريد التنتالوم. فكربون التحلل الحراري زائد عن الحد، ولا يمكن دمجه مع التنتالوم مع مرور الوقت، مما يؤدي إلى تغليف السطح بالكربون.
عندما تكون درجة الحرارة مناسبة، يصبح سطحطلاء TaCكثيفة.
تاكتذوب الجسيمات وتتجمع مع بعضها البعض، ويكتمل شكل البلورة، وينتقل حدود الحبوب بسلاسة.
3. نسبة الهيدروجين:
بالإضافة إلى ذلك، هناك العديد من العوامل التي تؤثر على جودة الطلاء:
-جودة سطح الركيزة
- حقل الغاز الترسيبي
- درجة تجانس اختلاط الغازات المتفاعلة
II. العيوب النموذجية لـطلاء كربيد التنتالوم
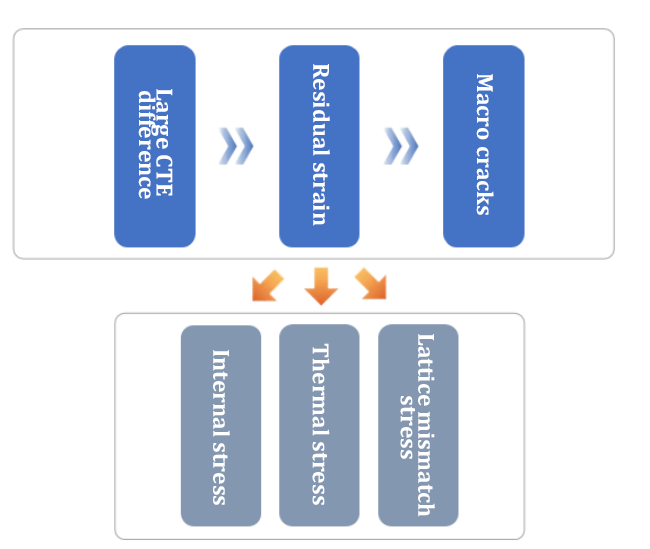
1. تشقق وتقشير الطلاء
معامل التمدد الحراري الخطي CTE الخطي:
2. تحليل العيوب:
(1) السبب:
(2) طريقة التوصيف
① استخدم تقنية حيود الأشعة السينية لقياس الضغط المتبقي.
② استخدم قانون هو كي لتقريب الإجهاد المتبقي.
(3) الصيغ ذات الصلة
3. تعزيز التوافق الميكانيكي بين الطلاء والركيزة
(1) طلاء النمو السطحي في الموقع
تقنية الترسيب والانتشار بالتفاعل الحراري TRD
عملية الملح المنصهر
تبسيط عملية الإنتاج
خفض درجة حرارة التفاعل
تكلفة أقل نسبيًا
أكثر صداقة للبيئة
مناسب للإنتاج الصناعي واسع النطاق
(2) طلاء انتقالي مركب
عملية الترسيب المشترك
أمراض القلب والأوعية الدمويةعملية
طلاء متعدد المكونات
الجمع بين مزايا كل مكون
تعديل تركيبة الطلاء ونسبته بمرونة
4. تقنية الترسيب والانتشار بالتفاعل الحراري TRD
(1) آلية التفاعل
تُسمى تقنية TRD أيضًا بعملية التضمين، والتي تستخدم نظام حمض البوريك - خماسي أكسيد التنتالوم - فلوريد الصوديوم - أكسيد البورون - كربيد البورون للتحضيرطلاء كربيد التنتالوم.
① حمض البوريك المنصهر يذيب أكسيد التنتالوم الخماسي؛
② يتحول أكسيد التنتالوم الخماسي إلى ذرات تنتالوم نشطة وينتشر على سطح الجرافيت؛
③ يتم امتصاص ذرات التنتالوم النشطة على سطح الجرافيت وتتفاعل مع ذرات الكربون لتكوينطلاء كربيد التنتالوم.
(2) مفتاح التفاعل
يجب أن يلبي نوع طلاء الكربيد الشرط المتمثل في أن تكون طاقة تكوين الأكسدة الحرة للعنصر الذي يشكل الكربيد أعلى من طاقة أكسيد البورون.
طاقة جيبس الحرة للكربيد منخفضة بدرجة كافية (وإلا، فقد يتكون البورون أو البوريد).
خماسي أكسيد التنتالوم أكسيد متعادل. في البوراكس المنصهر عالي الحرارة، يتفاعل مع أكسيد الصوديوم القلوي القوي لتكوين تانتالات الصوديوم، مما يُخفّض درجة حرارة التفاعل الأولية.
وقت النشر: ٢١ نوفمبر ٢٠٢٤